Le rôle de l’intestin dans les maladies auto-immunes : focus sur le microbiote
Rédaction : Anne-Christine DUSS, Nutritionniste
Les maladies auto-immunes sont des pathologies complexes où le système immunitaire attaque par erreur les propres cellules de l’organisme. Parmi les multiples facteurs impliqués, l’intestin joue un rôle central, notamment via le microbiote intestinal, un ensemble de micro-organismes vivant en symbiose avec notre corps. De nombreuses recherches ont démontré que des altérations du microbiote pourraient contribuer au développement et à la progression des maladies auto-immunes.
1. L’intestin, un acteur central de l’immunité
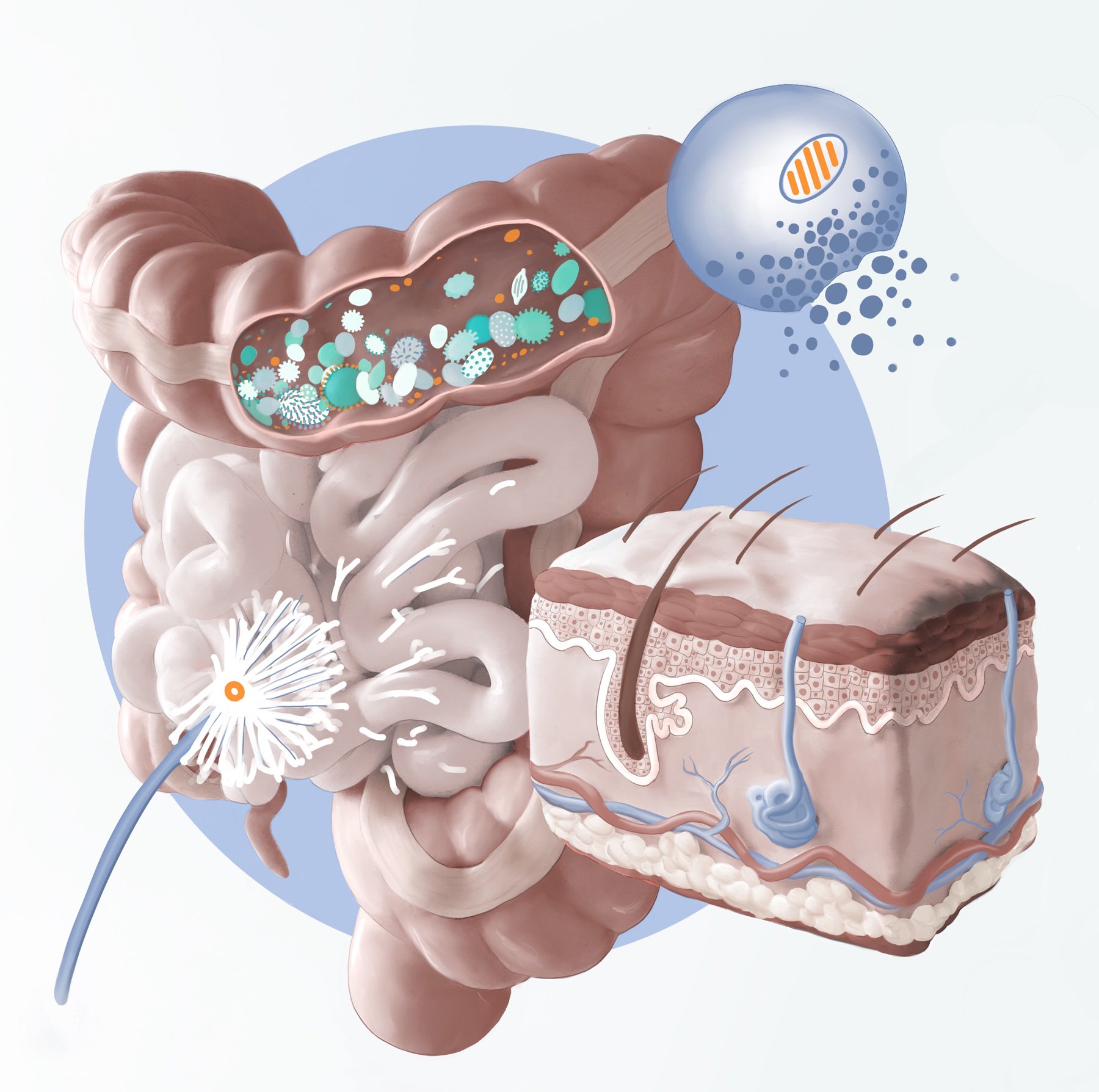
L’intestin est une barrière physique et immunitaire essentielle. Il abrite environ 70 % des cellules immunitaires de l’organisme et joue un rôle fondamental dans la régulation de la tolérance immunitaire. En effet, il est en contact permanent avec des milliards de micro-organismes, ainsi qu’avec les aliments ingérés, ce qui en fait un lieu stratégique pour la modulation du système immunitaire.
Le tissu lymphoïde associé à l’intestin (GALT) est l’une des principales structures immunitaires de cette barrière. Il contient des cellules immunitaires spécialisées, comme les lymphocytes T et B, ainsi que des macrophages et des cellules dendritiques, qui assurent une surveillance constante contre les agents pathogènes tout en maintenant une tolérance aux bactéries commensales et aux antigènes alimentaires. Cette tolérance est essentielle pour éviter des réponses immunitaires excessives pouvant mener à des maladies inflammatoires ou auto-immunes.
La perméabilité intestinale joue un rôle clé dans cet équilibre immunitaire. Normalement, la paroi intestinale est constituée de cellules épithéliales reliées par des jonctions serrées, qui contrôlent le passage des nutriments et empêchent l’intrusion de substances potentiellement nocives. Cependant, divers facteurs, tels que le stress, une alimentation déséquilibrée, des infections ou des déséquilibres du microbiote, peuvent altérer cette barrière et augmenter la perméabilité intestinale (phénomène de « leaky gut »). Cette hyperperméabilité permet le passage de molécules inflammatoires, de toxines et même de fragments bactériens dans la circulation sanguine, déclenchant une réponse immunitaire exacerbée pouvant conduire à des maladies auto-immunes.
2. Le microbiote intestinal et son influence sur l’auto-immunité
Le microbiote intestinal est constitué de milliards de micro-organismes, incluant des bactéries, des virus, des champignons et des archées, qui interagissent en permanence avec le système immunitaire. Cette interaction s’effectue notamment via la production de métabolites, comme les acides gras à chaîne courte (butyrate, propionate et acétate), qui modulent l’inflammation et renforcent la barrière intestinale. Certaines bactéries, comme les Firmicutes et les Bacteroidetes, jouent un rôle clé dans cet équilibre en régulant les réponses immunitaires et en empêchant la prolifération d’agents pathogènes.
Un équilibre entre les différentes populations microbiennes est essentiel pour maintenir une réponse immunitaire adaptée. Cet équilibre est influencé par plusieurs facteurs, tels que l’alimentation, l’exposition aux antibiotiques, le stress et les infections. Lorsque cet équilibre est perturbé, on parle de dysbiose. Celle-ci se caractérise par une diminution de la diversité bactérienne et une prolifération de bactéries opportunistes ou pathogènes. En cas de dysbiose, certaines bactéries pro-inflammatoires, comme Escherichia coli ou certaines souches de Clostridium, peuvent proliférer et produire des toxines ou des lipopolysaccharides (LPS) qui stimulent une réponse immunitaire excessive.
Cette dysbiose favorise un état inflammatoire chronique et une augmentation de la perméabilité intestinale. En conséquence, des fragments bactériens, des toxines et des molécules immunogènes peuvent traverser la barrière intestinale et entrer dans la circulation sanguine. Cette activation inappropriée du système immunitaire peut induire une inflammation systémique et contribuer à l’apparition ou à l’aggravation des maladies auto-immunes, comme la polyarthrite rhumatoïde, la sclérose en plaques ou la maladie cœliaque.
3. Maladies auto-immunes et altérations du microbiote
Plusieurs maladies auto-immunes sont associées à des modifications du microbiote intestinal :
- Maladie cœliaque : La présence de certaines bactéries favorise une réaction exacerbée au gluten, aggravant l’inflammation intestinale.
- Polyarthrite rhumatoïde : Des altérations du microbiote intestinal sont observées avant même l’apparition des symptômes.
- Sclérose en plaques : Certains déséquilibres du microbiote semblent moduler l’activité immunitaire en faveur de la neuro-inflammation.
- Diabète de type 1 : Des anomalies dans la composition du microbiote ont été liées à la destruction des cellules pancréatiques productrices d’insuline.
- Lupus érythémateux systémique : Une altération du microbiote, notamment une diminution des bactéries anti-inflammatoires, est impliquée dans l’activation du système immunitaire.
- Maladies inflammatoires de l’intestin (Crohn, rectocolite hémorragique) : Une dysbiose caractéristique avec une réduction des bactéries bénéfiques et une augmentation des bactéries pro-inflammatoires favorise l’inflammation chronique.
- Syndrome de Sjögren : Des modifications du microbiote pourraient jouer un rôle dans l’activation du système immunitaire et l’inflammation des glandes salivaires et lacrymales.
- Sclérodermie : Des déséquilibres du microbiote sont corrélés avec l’inflammation et la fibrose caractéristiques de cette maladie.
4. Restaurer un microbiote équilibré pour réguler l’immunité
Face à ces observations, de nombreuses stratégies visent à rétablir un équilibre du microbiote intestinal :
- Alimentation anti-inflammatoire : Riche en fibres, polyphénols et oméga-3, elle favorise la diversité du microbiote.
- Probiotiques et prébiotiques : Certains de ses suppléments (ciblés selon les besoins spécifiques de chacun.e) aident à repeupler l’intestin avec des bactéries bénéfiques.
- Réduction des toxines alimentaires : L’éviction de certains additifs et pesticides peut limiter l’altération du microbiote.
- Gestion du stress et activité physique : Ces facteurs influencent également la composition du microbiote et l’immunité.
Le rôle de l’intestin et du microbiote dans les maladies auto-immunes est de plus en plus mis en avant par la recherche scientifique. Une meilleure compréhension de ces mécanismes ouvre la voie à des stratégies thérapeutiques innovantes pour prévenir et atténuer les maladies auto-immunes par la modulation du microbiote intestinal.
Références :
-
Références scientifiques et médicales
-
Belkaid, Y., & Hand, T. W. (2014). Role of the microbiota in immunity and inflammation. Cell, 157(1), 121-141.
→ Étudie comment le microbiote intestinal influence l’immunité et les maladies inflammatoires. -
Honda, K., & Littman, D. R. (2016). The microbiota in adaptive immune homeostasis and disease. Nature, 535(7610), 75-84.
→ Discussion approfondie sur l’interaction entre le microbiote et le système immunitaire. -
Cani, P. D., & Everard, A. (2017). Talking microbes: When gut bacteria interact with diet and host organs. Molecular Metabolism, 6(1), 46-50.
→ Exploration du lien entre alimentation, microbiote et inflammation. -
Hall, A. B., Tolonen, A. C., & Xavier, R. J. (2017). Human genetic variation and the gut microbiome in disease. Nature Reviews Genetics, 18(11), 690-699.
→ Relation entre génétique, microbiote et maladies auto-immunes. -
Khan, M. T., Nieuwdorp, M., & Backhed, F. (2014). Microbial modulation of insulin sensitivity. Cell Metabolism, 20(5), 753-760.
→ Rôle du microbiote dans le diabète et la régulation du métabolisme. -
Vatanen, T., Kostic, A. D., & d’Hennezel, E. (2016). Variation in microbiome LPS immunogenicity contributes to autoimmunity in humans. Cell, 165(4), 842-853.
→ Impact des lipopolysaccharides bactériens (LPS) sur la réponse immunitaire et les maladies auto-immunes. -
Shahi, S. K., Freedman, S. N., Mangalam, A. K. (2017). Gut microbiome in multiple sclerosis: the players involved and the roles they play. Gut Microbes, 8(6), 607-615.
→ Lien entre microbiote et sclérose en plaques.
Sources institutionnelles et médicales
-
National Institutes of Health (NIH) : Publications et études sur le microbiote et les maladies auto-immunes. https://www.nih.gov
-
Harvard T.H. Chan School of Public Health : Articles sur l’impact du microbiote intestinal sur la santé. https://www.hsph.harvard.edu
-
Inserm (France) : Dossiers et études sur l’auto-immunité et le microbiote. https://www.inserm.fr
-
Mayo Clinic : Informations sur les maladies auto-immunes et la santé intestinale. https://www.mayoclinic.org
-